深圳湾实验室与清华大学等研究团队合作设计新型T细胞疫苗对抗新冠病毒变异株
2023年5月23日,来自深圳湾实验室、清华大学、中国医学科学院医学生物学研究所及复旦大学等机构的研究团队在 Nature Communications(自然通讯) 杂志发表题为An mRNA-based T-cell-inducing antigen strengthens COVID-19 vaccine against SARS-CoV-2 variants (基于mRNA的T细胞免疫抗原加强新冠疫苗抵御新冠病毒变异株) 的研究论文。该研究旨在通过协同激活细胞免疫和体液免疫应答,提升新冠疫苗免疫保护效果,有效应对新冠病毒突变造成的免疫逃逸。
当前新冠疫苗设计主要有两点问题需要进一步解决:1、疫苗免疫后抗体消减速度较快,仅从抗体角度可能无法提供长效保护,下一代新冠疫苗如何提供更强效保护?2、新冠病毒突变速度较快,可能导致现有疫苗保护作用降低或是丧失,新一代疫苗如何有效避免突变株免疫逃逸?
针对以上两个问题,研究人员首先系统分析新冠病毒基因组,发现在其非结构蛋白3(NSP-3), NSP-4和NSP-6中包含富集细胞免疫表位的区段,且在不同流行突变株间高度保守,并通过实验验证以上表位富集区可有效激活人体细胞免疫应答。研究人员进一步利用mRNA疫苗技术制备一种包括3种细胞免疫富集区的新型抗原HLA-EPs,可靶向激活T细胞免疫。利用HLA(人类白细胞抗原)人源化小鼠免疫攻毒模型开展免疫特征分析,证明细胞免疫抗原能够诱发高效免疫保护应答。该结果提示,利用协同激活细胞免疫及体液免疫的新冠病毒疫苗研发策略或可提升现有疫苗免疫保护效果。研究人员进一步提出“二价”mRNA疫苗设计方案,一方面以新冠病毒受体结合区(RBD)为基础,设计诱导中和抗体的靶向抗原HLA-RBD;另一方面,以筛选鉴定的HLA-EPs为诱导高效T细胞免疫的靶向抗原,依托诱导T细胞免疫的能力形成长效免疫保护。随后,研究人员利用HLA人源化小鼠模型和非人灵长类动物模型进行免疫保护效果评价,证明所设计的新型mRNA疫苗(HLA-RBD+HLA-EPs)既能诱导高滴度的交叉中和抗体,又能高效诱导活化细胞免疫应答,协同发挥功能、并高效保护新冠病毒Beta及Omicron变异株的感染与致病。本研究中,研究人员重点强化新冠疫苗对细胞免疫的激活能力,为下一代“强效+长效”新冠疫苗研发提供思路。协同激活细胞免疫和体液免疫应答的疫苗设计策略将有效提升传染病新型疫苗的免疫保护能力。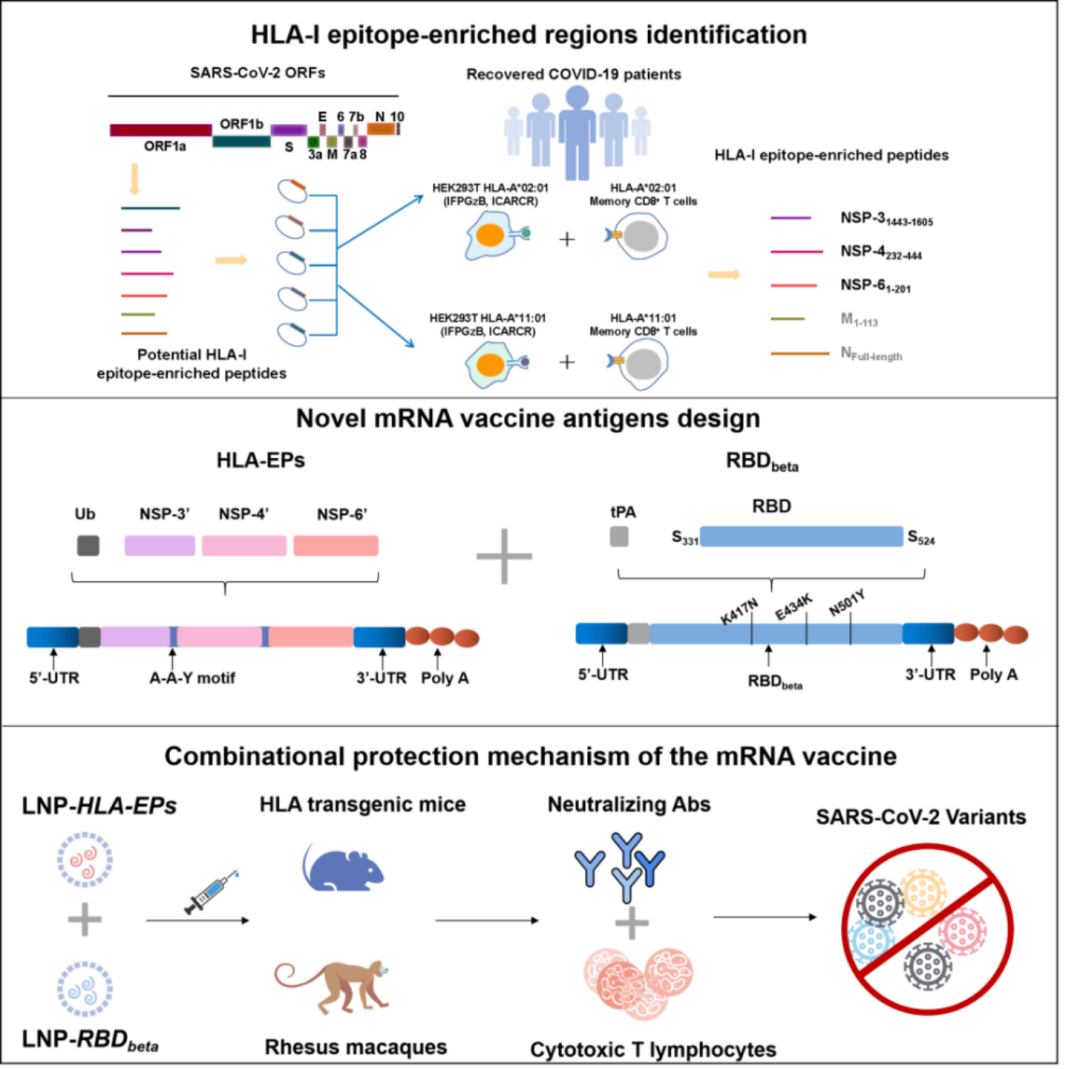
图1. 细胞免疫和体液免疫应答协同激活的新冠mRNA疫苗设计策略示意图
程功教授、中国医学科学院医学生物学研究所彭小忠研究员、孙强明研究员、复旦大学林金钟教授为本论文共同通讯作者。深圳湾实验室为第一完成单位,清华大学为第二完成单位。深圳湾实验室传染病研究所太万博博士、清华大学医学院博士后冯胜勇、柴本杰、中国医学科学院医学生物学研究所鲁帅尧教授、军事医学研究院微生物流行病研究所赵光宇研究员、温州医科大学检验医学院/生命科学学院陈栋教授、中国医学科学院医学生物学研究所禹文海博士为并列第一作者。该研究获科技部国家重点研发计划、国家自然科学基金基础科学中心、国家自然科学基金委杰出青年基金、国家自然科学基金委重点项目、国家自然科学基金委面上项目、国家自然科学基金委青年项目、广州实验室应急攻关项目、云南省专家工作站、佛山-清华产学研合作协同创新专项(佛山创新专项)、深圳市三名工程资助。
文章链接:https://www.nature.com/articles/s41467-023-38751-8