饶浪/程功等团队Science Advances:抗新冠肺炎地塞米松纳米吸入制剂
作者开发了一种基于胆固醇工程化改造中性粒细胞纳米囊泡的iSEND (inhaled, Self-immunoregulatory, Extracellular Nanovesicle-based Delivery) 新型递送载体,用于吸入递送皮质激素地塞米松 (DEX),提高新冠重症治疗疗效,降低DEX毒副作用。相较于DEX裸药,新型地塞米松纳米吸入制剂nanoDEX的肺部富集率提高超过14倍。相较于静脉注射DEX,吸入给药1/10剂量的nanoDEX,对SARS-CoV-2感染的非人灵长类动物模型的肺部炎症和损伤产生了更好的治疗效果。该研究提供了一种安全可靠的新型雾化吸入递送载体,有望为新冠肺炎和其他呼吸疾病的临床救治提供参考。
由于SARS-CoV-2引起的2019冠状病毒病(COVID-19)大流行,对公共卫生和全球经济产生了严重的影响[1]。为了消除病毒并抑制感染,身体对SARS-CoV-2感染作出免疫细胞激活和细胞因子分泌的反应。然而,被称为“细胞因子风暴”的细胞因子持续高水平分泌可能会加重炎症并导致免疫功能障碍。临床上,大多数COVID-19患者表现出轻度或中度症状,但约20%的患者会因细胞因子风暴而表现出严重肺炎,多器官衰竭甚至感染性休克。目前,仅有少数药物或治疗策略可用于治疗严重COVID-19患者。
地塞米松(DEX)是首个显示在严重COVID-19患者中具有挽救生命功效的药物[2]。在全球最大的涉及COVID-19的临床试验中,使用DEX可将COVID-19患者的死亡率降低。DEX预计将在COVID-19上产生重大影响,不仅因为DEX是首个显著提高患者生存率的药物,而且因为它广泛可得且非常便宜。然而,DEX是一种糖皮质激素,其受体广泛表达于大多数细胞类型,因此使用DEX可能会导致严重的副作用,例如骨质疏松和骨折、股骨缺血性坏死等,这些都限制了DEX广泛应用,特别是高剂量的长期治疗。尽管存在这些问题,DEX对抑制细胞因子可能是有益的,尤其是DEX可以被输送到肺组织和靶细胞,这些细胞在COVID-19治疗中起着关键作用。
细胞外囊泡(EVs)是细胞分泌的脂质囊泡,参与生理和病理过程,因此在免疫治疗方面具有巨大潜力[3]。此外,由于其良好的安全性和稳定性,EVs被视为下一代药物输送平台。然而,从生产方面来看,细胞分泌的EVs不足以用于免疫治疗和药物输送。因此,细胞源性纳米囊泡(NVs)已被用作EVs的替代品,可以通过超声波和细胞膜挤压制备。更重要的是,NVs还包含源细胞的特定脂质和蛋白质,因此继承了源细胞的独特性质[4]。例如,最近证明,NVs可以作为诱饵来捕获病毒和广谱细胞因子,抑制病毒感染和肺部炎症[5]。基于前期的工作研究,提出使用NVs载DEX的靶向输送和细胞因子的协同中和来改善COVID-19的治疗。
2023年6月14日,深圳湾实验室饶浪研究员、新加坡国立大学陈小元教授、清华大学程功教授等团队合作,在Science Advances 发表标题为“Inhalation delivery of dexamethasone with iSEND nanoparticles attenuates the COVID-19 cytokine storm in mice and non-human primates”的研究性论文。在该研究中,作者开发了一种可吸入的nanoDEX纳米制剂,包括负载DEX的中性粒细胞膜囊泡(N-NVs),以改善COVID-19治疗和并发症管理。通过利用吸入途径输送和N-NVs上丰富的趋化因子受体,nanoDEX在炎症肺部显示出增强的滞留能力和对激活的巨噬细胞和树突细胞的靶向能力。nanoDEX通过两步策略保护免受COVID-19细胞因子风暴的影响:第一步是细胞因子下调,随后是细胞因子中和(图1A)。nanoDEX在肺部的增强滞留能力促进了DEX的细胞因子下调作用,从而抑制了SARS-CoV-2感染引起的炎症细胞浸润和肺损伤。除此之外,依靠N-NVs上丰富的细胞因子受体,nanoDEX结合并中和广谱细胞因子,提高了COVID-19治疗的功效。由于在炎症肺部的增强滞留能力,nanoDEX治疗显著减轻了由DEX引起的骨质疏松,进一步凸显了nanoDEX的重要性。
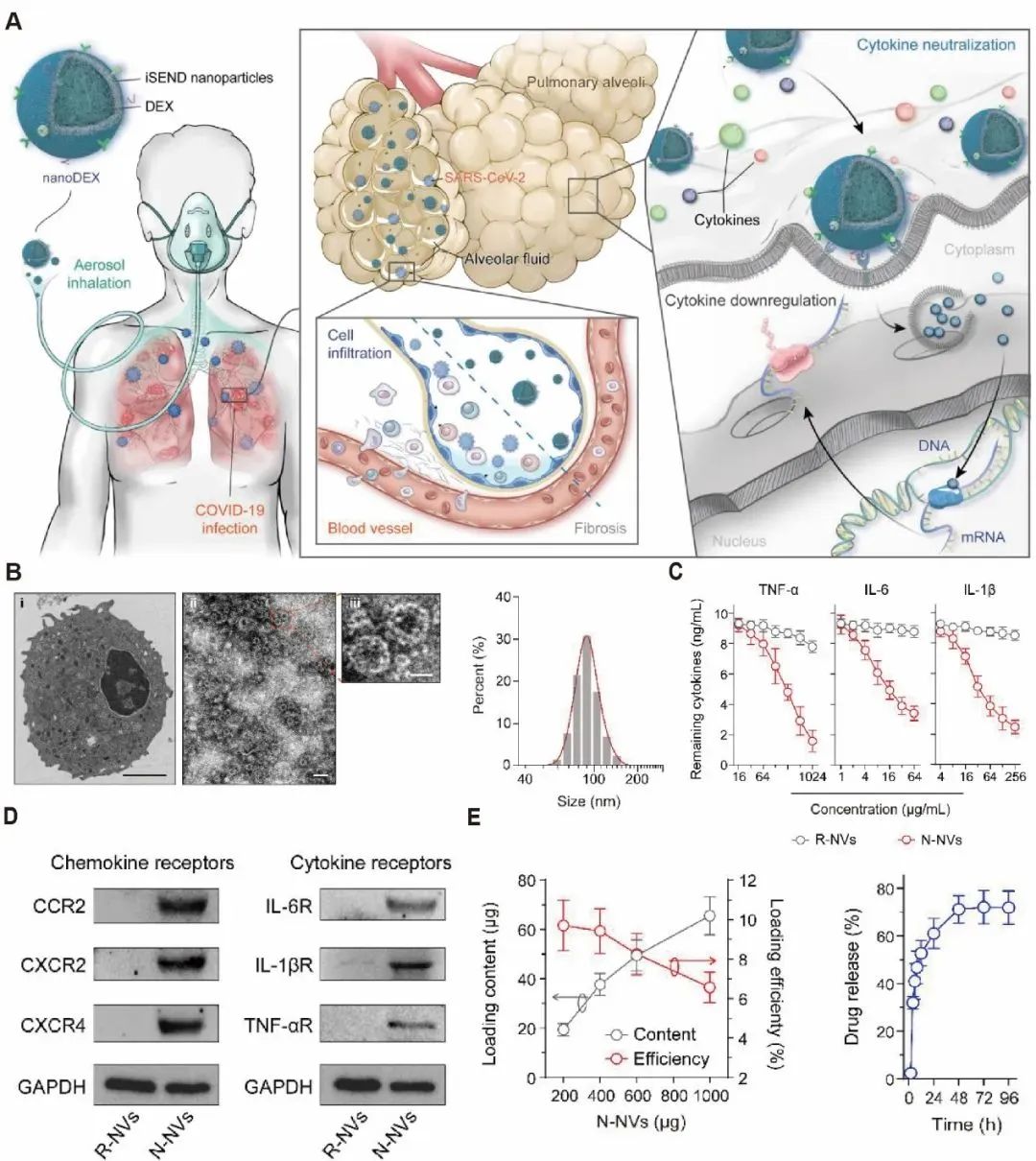
图1:(A) 可吸入nanoDEX用于治疗COVID-19的示意图。(B)中性粒细胞和N-NVs的TEM图,以及N-NVs粒径大小。(C) R-NVs和N-NVs的结合力分析。(D)趋化因子和细胞因子受体的Western blot分析。(E)N-NVs的载药率和释药率。
程本研究介绍了制备DEX-N-NVs的三个步骤:分离中性粒细胞、获得N-NVs、将DEX加载到N-NVs中。N-NVs是通过超声和小型挤压器的细胞膜纳米孔连续制备的,平均尺寸为90 nm(图1B)。N-NVs具有趋化因子和细胞因子受体,包括CCR2、CXCR2、CXCR4、IL-6R、IL-1βR和TNF-αR,依靠这些细胞因子受体可以高效地吸附炎症细胞因子(图1C,D)。DEX-N-NVs的最佳载药率约为9.71%,以及约71.16%的总DEX在48小时内从N-NVs中泄露出来,表明DEX-N-NVs具有持续释放的特点 (图1E)。
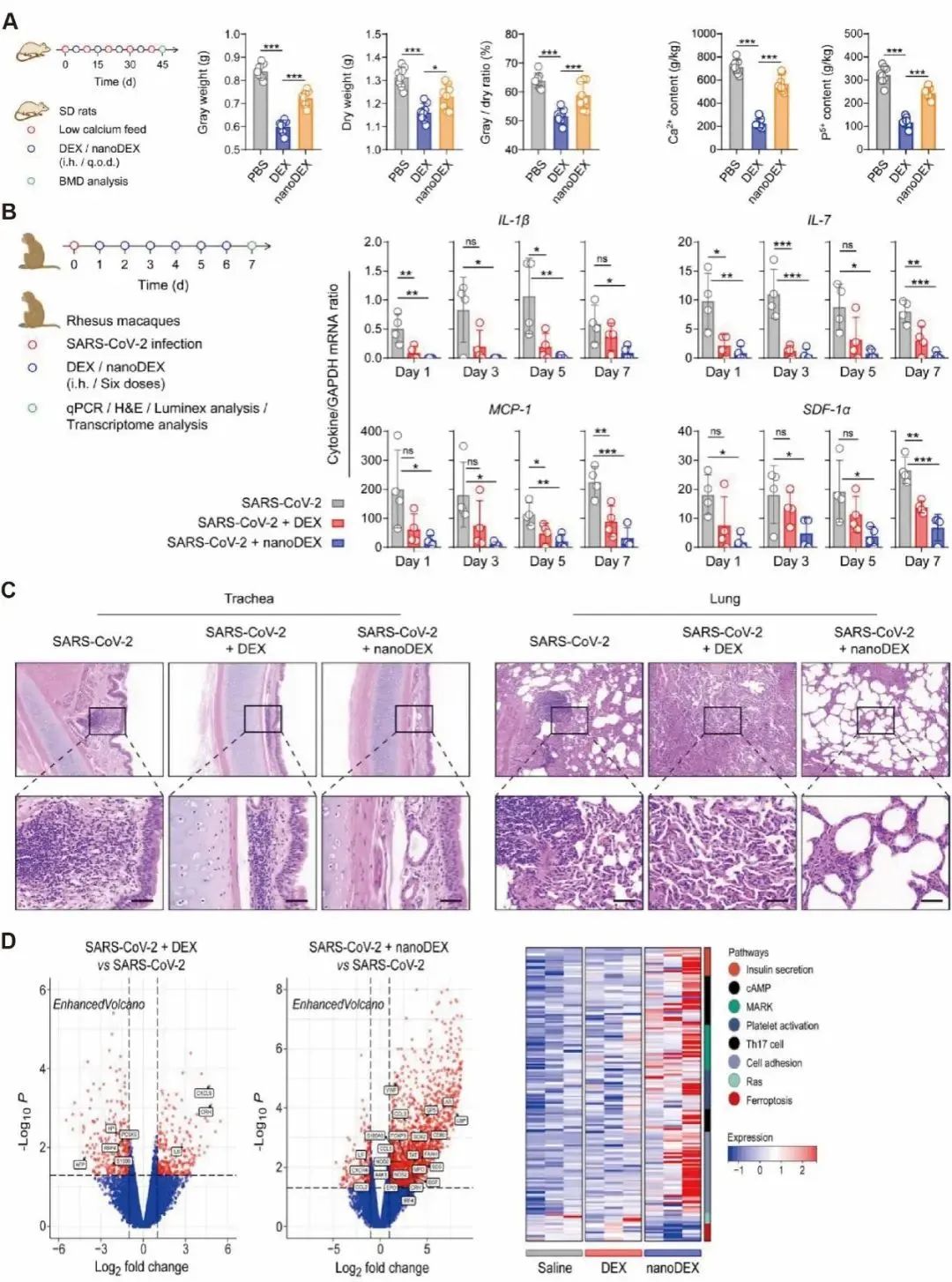
图2:(A) 经指示治疗后大鼠的骨灰重、干重和灰/干比分析和骨中Ca2+、P5+含量的变化。(B)恒河猴血清细胞因子基因表达qRT-PCR分析。(C)治疗后H&E染色气管和肺组织。(D)不同组之间肺部差异表达基因的火山图和与炎症损伤相关通路相关的基因的热图。
nanoDEX通过两步策略对抗COVID-19细胞因子风暴:第一步是DEX的细胞因子下调,第二步是iSEND的细胞因子中和。在LPS诱导的急性肺炎小鼠模型中,nanoDEX显著降低了肺部的细胞因子水平,并有效抑制了免疫失调状态,并且可显著抑制LPS诱导的肺损伤。为了研究nanoDEX的安全性,研究者们在大鼠模型中观察到,nanoDEX治疗显著保护了大鼠免受DEX引起的副作用的影响,包括骨质疏松症的发生(图2A)。
K18-hACE2转基因小鼠表达人类SARS-CoV-2受体(即血管紧张素转换酶2; ACE2),易感SARS-CoV-2感染,导致剂量依赖性的肺炎症状。研究通过吸入式给药途径将DEX或nanoDEX输送到小鼠肺部,发现nanoDEX可以有效地抑制SARS-CoV-2感染引起的肺部细胞因子/趋化因子上调,并减轻肺部损伤。此外,nanoDEX还能够抑制SARS-CoV-2感染引起的全身炎症反应,且使用nanoDEX的小鼠体重下降更缓,进一步证明了其生物安全性。
研究使用恒河猴测试了可吸入nanoDEX的抗COVID-19疗效。在遗传水平上,与DEX治疗相比,nanoDEX治疗有效抑制了SARS-CoV-2感染引起的细胞因子/趋化因子上调(图2B)。此外,吸入式给药输送的nanoDEX显著抑制了肺部损伤(图2C)。nanoDEX治疗后,与炎症和损伤修复相关的基因表达上调,凋亡通路的基因表达下降(图2D)。这项研究为COVID-19的治疗提供了新的治疗思路。总之,吸入式给药输送的nanoDEX显著抑制了肺部损伤,具有巨大潜力对于COVID-19相关的免疫失调和肺部损伤。该研究特别感谢国家自然科学基金委员会、广东省自然科学基金委员会、深圳市科技创新委员会、深圳湾实验室开放基金等经费支持。
参考文献:
[1] J. Zhou, C. Li, X. Liu, M.C. Chiu, X. Zhao, D. Wang, Y. Wei, A. Lee, A.J. Zhang, H. Chu, J.P. Cai, C.C. Yip, I.H. Chan, K.K. Wong, O.T. Tsang, K.H. Chan, J.F. Chan, K.K. To, H. Chen, K.Y. Yuen, Infection of bat and human intestinal organoids by SARS-CoV-2, Nat Med 26 (2020) 1077-1083.
[2] H. Ledford, Coronavirus breakthrough: dexamethasone is first drug shown to save lives,Nature 582 (2020) 469.
[3] P.D. Robbins, A.E. Morelli, Regulation of immune responses by extracellular vesicles, Nat Rev Immunol 14 (2014) 195-208.
[4] G. van Niel, G. D'Angelo, G. Raposo, Shedding light on the cell biology of extracellular vesicles, Nat Rev Mol Cell Biol 19 (2018) 213-228.
[5] L. Rao, S. Xia, W. Xu, R. Tian, G. Yu, C. Gu, P. Pan, Q.F. Meng, X. Cai, D. Qu, L. Lu, Y. Xie, S. Jiang, X. Chen, Decoy nanoparticles protect against COVID-19 by concurrently adsorbing viruses and inflammatory cytokines, Proc Natl Acad Sci U S A 117 (2020) 27141-27147.
文章链接:https://www.science.org/doi/10.1126/sciadv.adg3277
文章来源 | 深圳湾实验室医药所