Review丨金葡菌的新型抗体保护疗法综述
发布时间:
近日,深圳湾实验室传染病研究所陈新海团队和美国芝加哥大学微生物系Dominique Missiakas教授联合在Annual Review of Microbiology上发表题为“Novel Antibody-Based Protection Therapeutics in Staphylococcus aureus” 的综述论文。
金葡菌因其菌落呈金黄色而得名。作为一种革兰氏阳性病原菌,它广泛定植于人体鼻腔和皮肤,通常不会引发症状,但在免疫系统受损或天然屏障被破坏时,可能导致严重感染,如菌血症、败血症、肺炎等。仅2017年,美国金葡菌感染导致近20,000人死亡,医疗费用高达150亿美元。金葡菌可通过血液传播,侵入身体形成由中性粒细胞包围的化脓性脓肿(图 1)。此外,金葡菌可编码促粘附、凝血和抗体结合的蛋白质,使其能够逃避宿主的免疫防御。金葡菌还可以通过毒力因子如Cna、Sbi和SpA等干扰补体激活和抗体功能,从而抑制吞噬作用,并通过操控B细胞和T细胞的免疫反应,进一步削弱宿主的免疫防御。尽管现代医学在去除金葡鼻腔定植和使用抗生素治疗方面取得了一定进展,但金葡菌的感染仍然是医疗领域的一大难题,尤其是甲氧西林耐药性金葡菌(MRSA)的出现,使得治疗复杂化。在治疗难治性感染或毒性休克综合征(TSS)时,静脉注射免疫球蛋白(IVIG)可能成为有效的替代疗法。
之前金葡菌的抗体主要靶向荚膜多糖和细菌毒素,但在临床试验中未获得预期的效果,这可能是由于荚膜成分在不同菌株中的不同所致。此外,靶向可溶性毒素如α-溶血素、白细胞杀伤素的抗体尽管在动物模型和临床血清学研究显示可减轻疾病程度,但要完全清除病原体还需其他免疫机制。评估抗体提供的保护能力是通过一系列方法来实现的,这些方法通常包括测量抗体水平、中和能力以及促进吞噬作用或其他效应功能的能力。这些评估对于确定抗体的有效性至关重要。通过对抗体进行改造可提高其亲和力、延长半衰期并优化下游的效应功能。运用基因工程技术,科学家们已能生产出嵌合的人源化以及全人源化抗体。这些技术使得研究人员能设计出更高效、特异的抗体。除此之外,宿主的免疫状态以及先前感染的历史等因素都是确定最佳的抗体治疗方法需要考虑的因素。
基于抗体的金葡菌治疗策略目前虽未成功,但已有重大进展。早期由于对金葡菌抗原选择不当、毒力靶标的多样性,以及临床前试验和保护相关性不足导致许多疫苗及抗体疗法都失败了。但这些尝试提供了宝贵的经验和见解。这些经验指导我们对结合金葡的抗体进行工程改造,以应对细菌蛋白SpA、Sbi和蛋白酶的干扰。目前仍有许多挑战待克服。如何在持续暴露于金葡菌的人群中测试候选疗法?哪些患者最有可能从这些疗法中受益?对健康个体的预防研究可能为金葡菌疫苗的开发提供更好的结果。反过来,这种成功可能会指导抗体介导的金葡菌杀伤机制的发展。
文章链接:https://www.annualreviews.org/content/journals/10.1146/annurev-micro-041222-024605

金葡菌因其菌落呈金黄色而得名。作为一种革兰氏阳性病原菌,它广泛定植于人体鼻腔和皮肤,通常不会引发症状,但在免疫系统受损或天然屏障被破坏时,可能导致严重感染,如菌血症、败血症、肺炎等。仅2017年,美国金葡菌感染导致近20,000人死亡,医疗费用高达150亿美元。金葡菌可通过血液传播,侵入身体形成由中性粒细胞包围的化脓性脓肿(图 1)。此外,金葡菌可编码促粘附、凝血和抗体结合的蛋白质,使其能够逃避宿主的免疫防御。金葡菌还可以通过毒力因子如Cna、Sbi和SpA等干扰补体激活和抗体功能,从而抑制吞噬作用,并通过操控B细胞和T细胞的免疫反应,进一步削弱宿主的免疫防御。尽管现代医学在去除金葡鼻腔定植和使用抗生素治疗方面取得了一定进展,但金葡菌的感染仍然是医疗领域的一大难题,尤其是甲氧西林耐药性金葡菌(MRSA)的出现,使得治疗复杂化。在治疗难治性感染或毒性休克综合征(TSS)时,静脉注射免疫球蛋白(IVIG)可能成为有效的替代疗法。
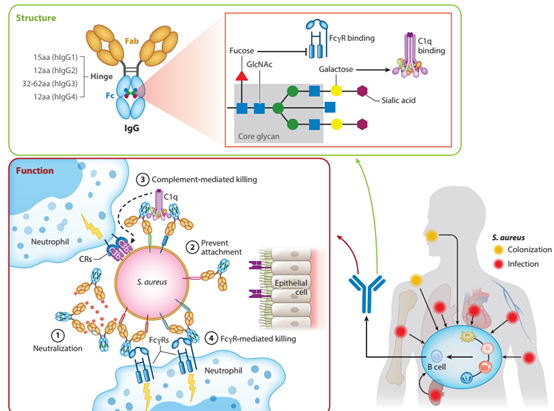
图1 金葡菌与宿主以及抗体互作
由于在调节免疫应答和破坏病原体方面具有多功能性,IgG 是临床抗体药物开发的首选型。IgG 因其亚类不同而具有不同的丰度、血清半衰期和对 Fc 结合分子的亲和力,从而产生独特的免疫结果 (图 1)。IgG 的 Fab 结构域可与抗原形成免疫复合体 (IC),Fc 结构域存在不同的糖基化修饰影响与 Fc 结合分子和可溶性受体的相互作用并调节下游通路。IgG抗体和I型FcγRs、CIq、FcRn的相互作用影响抗体依赖的细胞吞噬作用和补体依赖性细胞吞噬作用。金葡菌已经进化出多种毒力机制来降低抗体的活性,特别是减少和操纵 IgG 和 Fc 结合分子、FcγRs、补体 C1q 和 FcRn 之间的相互作用(图 2a)。金葡菌产生三种 IgG-Fc 结合蛋白,即SpA、Sbi和SSL10(图 2a,b),抑制补体激活效率和 IgG 介导的吞噬作用(图 2b),最终降低治疗性 IgG 的半衰期,并减少金葡菌感染期间对 IgG IC的免疫反应。此外,金葡菌通过分泌的毒力因子或上调宿主细胞相关蛋白酶以降解抗体,同时可通过抑制补体的功能以达到抗宿主免疫反应(图 2b)。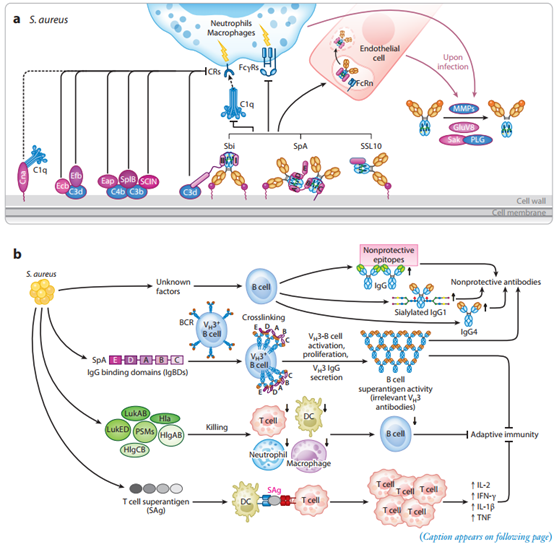
图2 金葡菌干扰抗体以及宿主免疫应答反应
文章来源 | 陈新海课题组