
刘洋
Yang LIU
特聘研究员
liuy(at)szbl.ac.cn
Timeline
| 2022 至今 | 深圳湾实验室传染病研究所 | 特聘研究员 |
| 2018-2021 | 美国德克萨斯大学医学分部生物化学和分子生物学系 | 博士后 |
| 2013-2018 | 清华大学生命科学院 | 博士 |
| 2011-2013 | 清华大学医学院 | 高级科研助理 |
| 2008-2011 | 深圳北科生物科技有限公司 | iPS研发高级科研助理 |
| 2007-2008 | 香港中文大学生物系 | 科研助理 |
| 2002-2006 | 复旦大学生命科学院 | 学士 |
研究领域
刘洋课题组主要着眼于重要病毒传染病的遗传进化和致病机理研究,以及新型抗病毒策略及病毒工具的研发。其运用反向遗传学,病毒学,免疫学,生物信息学和各种组学研究手段,寻找病毒上和宿主中影响病毒感染和传播的重要突变和关键因子,阐述其发挥作用的分子机制;并以这些病毒突变和宿主因子为靶点,研发新型抗病毒策略和治疗手段。同时,刘洋课题组开发各种病毒工具用于基础研究,药物、抗体和疫苗研发、病毒载体递送,为各种病毒传染病的防控和基因治疗提供科技支撑。
成果
刘洋博士于2018年在清华大学博士毕业,随后加入美国德克萨斯大学医学部(UTMB)史佩勇教授课题组攻读博士后。刘洋博士长期专注于病毒遗传进化、致病机理研究,以及病毒工具和抗病毒策略的开发。其研究鉴定新冠病毒、登革病毒和寨卡病毒上的多个影响病毒感染和传播的重要氨基酸突变,揭示了这些病毒在自然界中的遗传进化规律,为这些病毒疫情的防控提供了科学指导。刘洋博士在新冠疫情发生后,搭建了多种研究新冠病毒的重要反向遗传学平台,并在世界上首次评估了新冠疫苗对多种突变新冠病毒中和能力的变化,为新冠疫苗后续接种策略的改进提供了重要依据。刘洋博士于2022年加入深圳湾实验室传染病所,任特聘研究员,获得西湖大学/华南理工大学/中山大学的博士生/硕士生导师资格。其归国后获得了2021年中华医学科技奖二等奖(第3完成人),2022年教育部科学技术奖一等奖(第4完成人);主持2022年国家优秀青年科学基金项目(海外)、国自然面上、国自然专项和国家重点研发计划子课题负责人等科研项目。其研究成果以第一作者/通讯作者(含共一/共通讯)的身份发表于Nature, New Engl. J. Med., Cell, Nat. Med., Nat. Microbio, Nat. Commun.等国际知名期刊;包括4篇Nature,2篇NEJM,1篇Cell等,累计影响因子达600,所有文章引用次数超4500次。
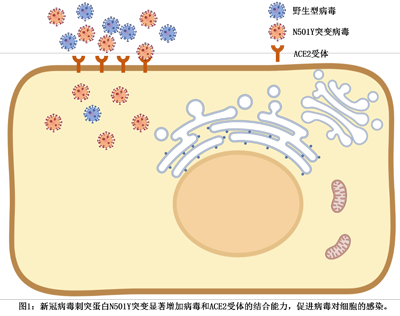
图一:在这项研究中,我们发现并验证了新冠病毒刺突蛋白上的第501位氨基酸从天冬酰胺到酪氨酸的突变,能显著增加新冠病毒和ACE2受体的结合,促进病毒的感染和传播。该项研究揭示了新冠病毒alpha毒株在2021年初在全球大规模流行的原因。
图二:这项研究使用反向遗传学手段,在世界上首次搭建了新冠突变病毒重组活病毒平台,检测了新冠疫苗免疫后的人群抗血清对不同变种的新冠病毒毒株中和能力的变化,为新冠病毒的疫苗的后续改进提供了重要的第一手信息。
图三:在这项研究中,我们发现寨卡病毒NS1蛋白上的第188位氨基酸从丙氨酸到缬氨酸的突变,会增加NS1蛋白在宿主血液循环系统中的分泌量。NS1蛋白会伴随着蚊虫吸血获取病毒时进入蚊虫体内,抑制蚊虫肠道的免疫系统,从而增加寨卡病毒对蚊虫的感染;导致自然界中携带病毒的蚊虫数目增加,促进了病毒的传播,从而引发了2017年寨卡病毒在南美洲的大规模爆发流行。
荣誉奖励
• 2022 教育部科学技术奖一等奖(第四完成人)
• 2021 中华医学会医学科学技术奖二等奖(第三完成人)
• 2018 吴瑞奖学金
• 2017 博士生国家奖学金
• 2017 第十二届全国病毒学学术研讨会,论文一等奖
• 2015 博士生国家奖学金
• 2014 清华大学一等奖学金
• 2013 清华大学迷你盖茨基金,一等奖
媒体报道
1. 人物 | 刘洋:三十年步履不停,从自然观察家到病毒学斗士
2. 新冠病毒变种和疫苗接种-BioArt与一作面对面(病毒篇第二期)
3. 新冠病毒的疫苗策略和接种
4. 新冠病毒的遗传进化之路
代表论文
1. Liu Y*, Liu J*, Plante KS*, Plante JA, Xie X, Zhang X, Ku Z, An Z, Scharton D, Schindewolf C, Menachery VD, Shi PY and Weaver SC. The N501Y spike substitution enhances SARS-CoV-2 infection and transmission. Nature 602: 294–299 (2022).
2. Liu Y*, Zhang X*, Liu J*, Xia H*, Zou J, Muruato AE, Periasamy S, Kurhade C, Plante JA, Bopp NE, Kalveram B, Bukreyev A, Ren P, Wang T, Menachery VD, Plante KS, Xie X, Weaver SC and Shi PY. A live-attenuated SARS-CoV-2 vaccine candidate with accessory protein deletions. Nature communications 13: 4337 (2022)
3. Liu Y*, Liu J*, Zou J*, Kalveram B, Machado RR, Ren P, Türeli S, Smith DJ, Weaver, SC, Xie, X and Shi PY. Cross-neutralization and cross-protection among SARS-CoV-2 viruses bearing different variant spikes. Signal Transduction and Targeted Therapy 7: 285 (2022).
4. Liu Y*, Liu J*, Xia H, Zhang X, Fontes-Garfias CR, Swanson KA, Cai H, Sarkar R, Chen W, Cutler M, Cooper D, Weaver SC, Muik A, Sahin U, Jansen KU, Xie X, Dormitzer PR and Shi PY. Neutralizing activity of BNT162b2-elicited serum. New England Journal of Medicine 384: 1466-1468 (2021)
5. Plante JA*, Liu Y*, Liu J*, Xia H, Johnson BA, Lokugamage KG, Zhang X, Muruato AE, Zou J, Fontes-Garfias CR, Mirchandani D, Scharton D, Bilello JP, Ku Z, An Z, Kalveram B, Freiberg AN, Menachery VD, Xie X, Plante KS, Weaver SC and Shi PY. Spike mutation D614G alters SARS-CoV-2 fitness. Nature 592: 116-121 (2021).
6. Liu Y*, Liu J*, Xia H, Zhang X, Zou J, Fontes-Garfias CR, Weaver SC, Swanson KA, Cai H, Sarkar R, Chen W, Cutler M, Cooper D, Muik A, Sahin U, Jansen KU, Xie X, Dormitzer PR and Shi PY. BNT162b2-elicited neutralization against new SARS-CoV-2 spike variants. New England Journal of Medicine 385: 472-474 (2021)
7. Zhang, X*, Liu, Y*, Liu, J, Bailey, AL, Plante, KS, Plante, JA, Zou, J, Xia, H, Bopp, NE, Aguilar, PV, Ren, P, Menachery, VD, Diamond, MS, Weaver, SC, Xie, X, Shi, P-Y. A trans-complementation system for SARS-CoV-2 recapitulates authentic viral replication without virulence. Cell 184: 2229-2238.e13 (2021).
8. Liu J*, Liu Y*, Xia H, Zou J, Weaver SC, Swanson KA, Cai H, Cutler M, Cooper D, Muik A, Jansen KU, Sahin U, Xie X, Dormitzer PR and Shi PY. BNT162b2-elicited neutralization of B.1.617 and other SARS-CoV-2 variants. Nature 596: 273-275 (2021).
9. Du SY*, Liu Y*, Liu J*, Zhao J, Champagne C, Tong L, Zhang R, Zhang F, Qin CF, Ma P, Chen CH, Liang G, Liu Q, Shi PY, Cazelles B, Wang P, Tian H and Cheng G. Aedes mosquitoes acquire and transmit Zika virus by breeding in contaminated aquatic environments. Nature communication 10: 1324 (2019).
10. Liu Y*, Liu J*, Du S*, Shan C*, Nie K, Zhang R, Li XF, Zhang R, Wang T, Qin CF, Wang P, Shi PY and Cheng G. Evolutionary Enhancement of Zika Virus Infectivity in Aedes Aegypti Mosquitoes. Nature 545: 482 (2017).