传染病研究所与合作者发现一种维生素A衍生物可显著抑制新冠病毒感染
发布时间:
2022年7月13日,程功团队及合作者在《mBio》(微生物) 杂志发表题为《A retinol derivative inhibits SARS-CoV-2 infection by interrupting spike-mediated cellular entry》(一种维生素A衍生物可抑制新冠病毒进入宿主细胞)的研究论文。该研究发现一种维生素A的衍生物全反式维甲酸(ATRA)可显著抑制新冠病毒感染人细胞和支气管及肺泡类器官(图1)。结构解析发现,ATRA结合在新冠病毒spike蛋白两个相邻RBD交接处的疏水口袋,通过类似“分子胶水”的作用将RBD锁定在“down”的构象,从而抑制其与ACE2蛋白结合(图2),是抗新冠药物研究的潜在靶点。
作为人体维持正常生理功能所必须的有机物质,维生素在人体的生长、代谢、发育与免疫等过程中发挥了重要功能。维生素A是天然免疫和适应性免疫的调节因子,可调控机体免疫稳态,影响多种RNA病毒感染COVID-19患者急性炎症期间维生素A水平显著降低,低水平的维生素A与急性呼吸窘迫综合征的发生和死亡率的升高有一定的相关性。动物体内维生素A可通过细胞膜上的受体进入细胞,被氧化成全反式视黄醛,并在视黄醛脱氢酶的作用下产生全反式维甲酸(ATRA)。ATRA可被细胞色素P450家族成员氧化为全反式4-羟基维甲酸和全反式4-氧戊二酸。维生素A及其衍生物在机体代谢与免疫过程发挥了重要作用。本研究探究了维生素A及其衍生物对新冠病毒感染的影响,通过比较5种小分子在Vero细胞中的抗病毒作用,发现ATRA的选择性指数最大,抗病毒效果最为显著。除Vero细胞外,ATRA还可显著抑制新冠病毒感染人Caco-2细胞和支气管及肺泡类器官。
作为人体维持正常生理功能所必须的有机物质,维生素在人体的生长、代谢、发育与免疫等过程中发挥了重要功能。维生素A是天然免疫和适应性免疫的调节因子,可调控机体免疫稳态,影响多种RNA病毒感染COVID-19患者急性炎症期间维生素A水平显著降低,低水平的维生素A与急性呼吸窘迫综合征的发生和死亡率的升高有一定的相关性。动物体内维生素A可通过细胞膜上的受体进入细胞,被氧化成全反式视黄醛,并在视黄醛脱氢酶的作用下产生全反式维甲酸(ATRA)。ATRA可被细胞色素P450家族成员氧化为全反式4-羟基维甲酸和全反式4-氧戊二酸。维生素A及其衍生物在机体代谢与免疫过程发挥了重要作用。本研究探究了维生素A及其衍生物对新冠病毒感染的影响,通过比较5种小分子在Vero细胞中的抗病毒作用,发现ATRA的选择性指数最大,抗病毒效果最为显著。除Vero细胞外,ATRA还可显著抑制新冠病毒感染人Caco-2细胞和支气管及肺泡类器官。
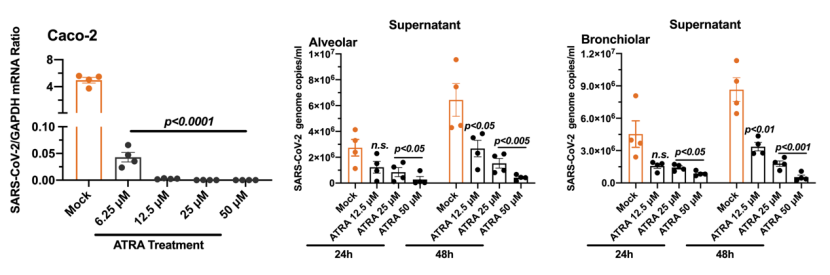
图1. ATRA显著抑制新冠病毒感染人细胞和类器官
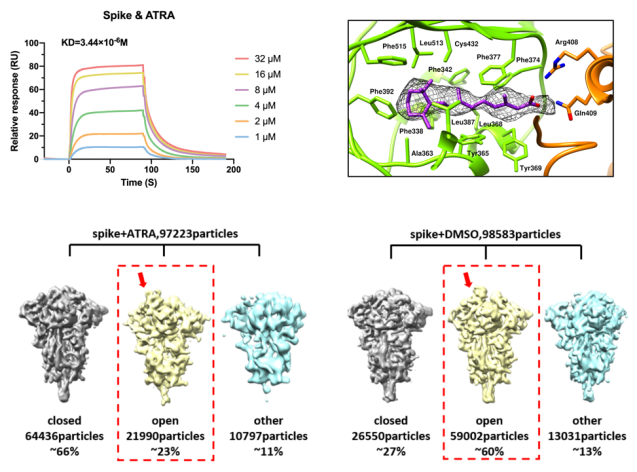
图2. ATRA抑制新冠病毒感染的分子机制
ATRA可与新冠病毒spike蛋白RBD结构域的疏水口袋结合,使得大多数spike蛋白的RBD结构域处于“down”的构象,从而抑制其与ACE2蛋白的结合
文章链接:https://doi.org/10.1128/mbio.01485-22
来源 | 传染病研究所