传染病研究所陈新海团队与合作者研究发现了宿主遗传背景影响单抗作用的机制

开发控制细菌耐药及其感染的有效手段符合国家的重大战略需求,且刻不容缓。金葡菌 (Staphylococcus aureus) 是院内六大多重耐药致病菌之一。但自2005年以来,包括辉瑞、诺华、葛兰素史克等制药公司的数十种抗金葡菌的疫苗和单抗疗法均未在临床试验中获得成功,失败原因尚不明朗。该课题组之前研究发现,金葡菌SpA蛋白是该病原菌发挥抗体免疫逃逸的关键分子,它能够特异性抑制抗体恒定区与补体 C1q 和受体 FcRn 的结合,导致免疫细胞活化降低、抗体半衰期及抗原递呈能力变弱;开发针对SpA免疫逃逸的工程化单抗 (3F6-IgG) 具有更强的保护作用,但该抗体具体的下游作用机制仍然不清。
抗体恒定区氨基酸的差异是区分不同抗体类型 (IgG、IgA 等) 和亚型 (IgG1、IgG3 等) 的主要依据,也是导致不同抗体下游功能发生变化的根本性原因,因此依据不同抗体类型或者亚型对恒定区进行改造可以研究抗体功能的作用机制及其在不同宿主遗传背景中的作用差异。
在本项研究中,研究人员对金葡菌抗体3F6-IgG进行恒定区改造,获得了4个亚型:mIgG1、mIgG2a、mIgG2b 和 mIgG3 (图1A),发现这些抗体的活性在 C57BL/6J 小鼠中排序是 IgG2a > IgG2b ≥ IgG1 > IgG3,而在 BALB/cJ小鼠中它们都有很好的抗金葡菌活性,彼此没有显著差异 (图1B和1C),表明抗体功能和宿主的遗传背景相关联。
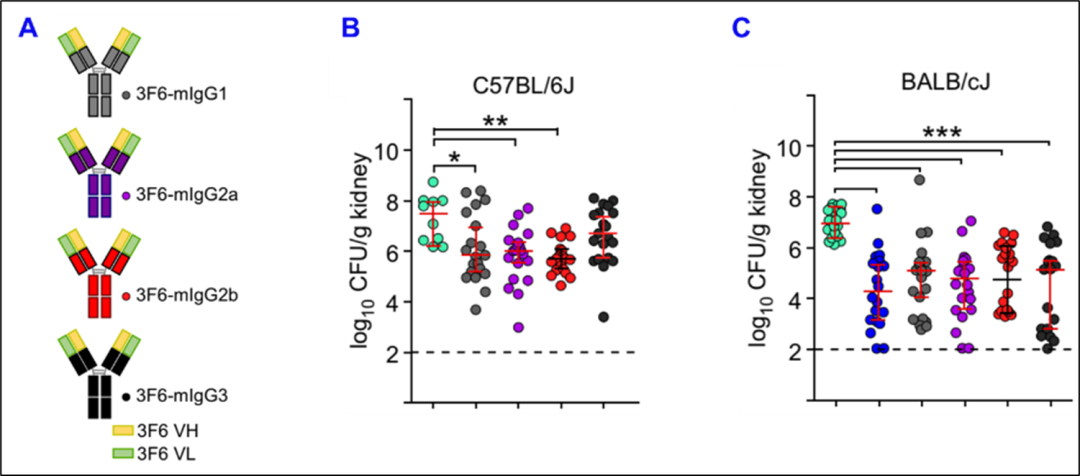 图1. 不同单抗亚型在C57BL/6J和BALB/cJ小鼠感染模型中的抗金葡菌活性(图源:X Chen, et al., PNAS, 2023)
图1. 不同单抗亚型在C57BL/6J和BALB/cJ小鼠感染模型中的抗金葡菌活性(图源:X Chen, et al., PNAS, 2023)
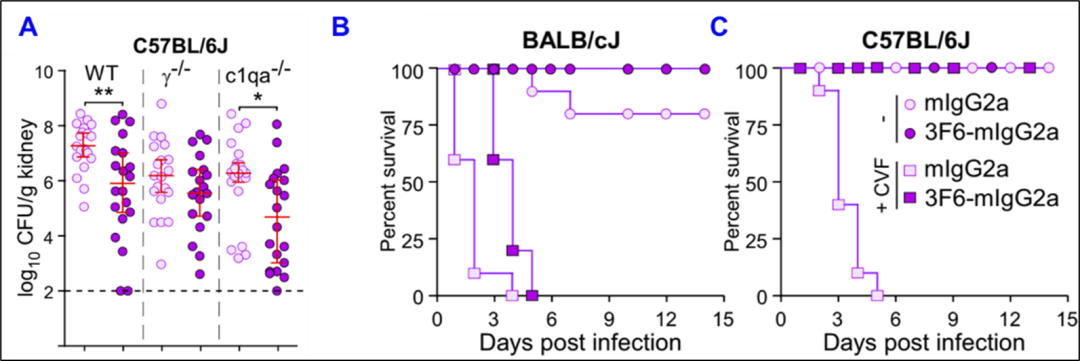 图2. 金葡菌抗体依赖不同下游效应器起抗感染功能(图源:X Chen, et al., PNAS, 2023)
图2. 金葡菌抗体依赖不同下游效应器起抗感染功能(图源:X Chen, et al., PNAS, 2023)
研究人员在进一步实验中发现,这两类小鼠血液中的中性粒细胞的比例差异很大,而且FcγRIV 和 CR3 的表达丰度在这两种来源的中性粒细胞上也差异明显。与 BALB/cJ 小鼠对比,不管是生理条件还是金葡菌感染状态下,C57BL/6J 小鼠的中性粒细胞都表达更高的FcγRIV和更低的CR3 (图3A和3B)。封闭 FcγRIV 或 CR3 的功能,可以很好的抑制金葡菌3F6抗体在 C57BL/6J 或 BALB/cJ 小鼠中的抗感染能力(图3C和3D)。这些结果表明抗体功能受宿主免疫细胞的抗体下游受体表达模式的调控,其作用机制呈现了明显的群体遗传背景偏好性。
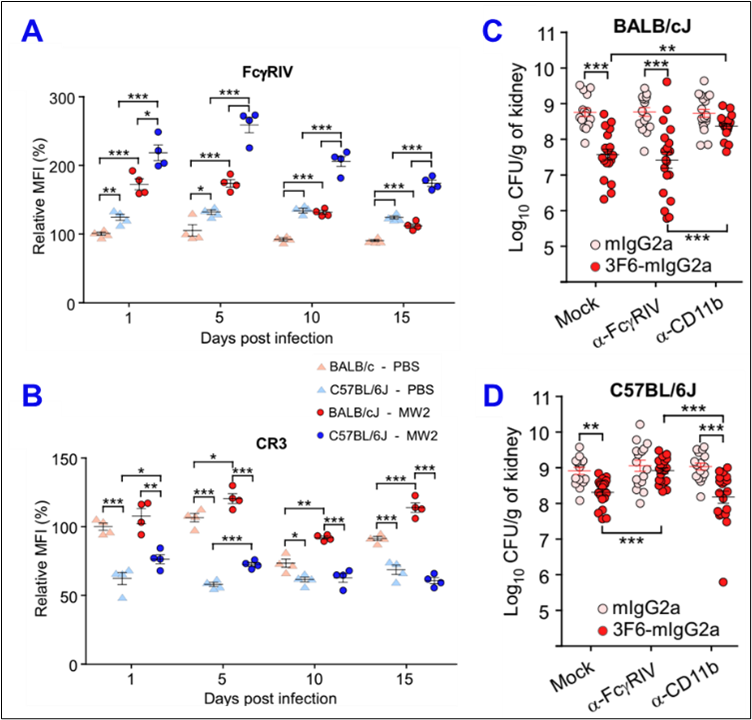
图3. 下游受体表达模式的差异决定抗体在不同品系小鼠中的抗感染机制不同 (图源:X Chen, et al., PNAS, 2023)
文章链接:https://www.pnas.org/doi/10.1073/pnas.2220765120
来源 | 传染病研究所